Gewebsinteraktionen und Signalmechanismen im Darmkrebs
Unsere Arbeitsgruppe erforscht die zellulären und molekularen Vorgänge bei der Entstehung von Darmkrebs. Insbesondere interessiert uns die Kommunikation verschiedener Zelltypen in der unmittelbaren Umgebung des Tumors, dem sogenannten „Tumor-Microenvironment”. Dabei nutzen wir „Organoide“, ein neuartiges dreidimensionales Gewebekultur-System.
Das Kolorektale Karzinom (CRC) ist eine der häufigsten krebsbedingten Todesursachen. Es ist durch zahlreiche genetische und epigenetische Veränderungen gekennzeichnet. Der individuelle Tumorphänotyp wird stark von der Mikroumgebung des Tumors beeinflusst, zu der Fibroblasten, Gefäße und Immunzellen gehören. Um diese komplexe Krankheit zu untersuchen und personalisierte therapeutische Strategien zu entwickeln, ist ein umfassender Ansatz erforderlich.
Experimentelle Modelle für die Mikroumgebung von Darmkrebs
Vom Patienten stammende Tumororganoide und Ko-Kulturmodelle
Patienten-abgeleitete Organoide (PDOs) haben sich als Forschungsmodell etabliert, das die 3D-Organisation des gastrointestinalen Epithels nachahmt. Darüber hinaus können Ko-Kulturen mit Stromazellen durchgeführt werden, um ein gewebeähnliches Umfeld zu simulieren. Mittels PDOs können „lebende Biobanken“ aufgebaut und kryokonserviert werden, welche die Tumor-Heterogenität zwischen Patienten repräsentieren. In Zusammenarbeit mit dem Universitären Tumorzentrum Frankfurt und mit Unterstützung des Frankfurt Cancer Institute (FCI) betreiben wir die FCI Organoid Biobank, um die Kultur und Analyse von PDOs zu unterstützen.
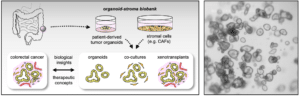
Genetische Regulatoren der CRC-Mikroumgebung
Die Homöostase des Gewebes hängt von der Interaktion der Stammzellen mit Signalen aus der Mikroumgebung ab. In Tumoren ist diese Interaktion gestört, was zu unkontrolliertem Wachstum führt. Zur Untersuchung der Kommunikation zwischen den unterschiedlichen Zelltypen im CRC verwenden wir Organoid Ko-Kulturen und Transplantationsmodelle. Kürzlich haben wir festgestellt, dass Mutationen, welche die Wnt-Signalübertragung aktivieren, auch die krebsassoziierten Fibroblasten (CAFs) beeinflussen. Die Hemmung des Wnt-Signals führt dabei zu einem CAF-Subtyp, der Tumorzellen invasiver macht (Mosa et al., Cancer Research 2020), was zeigt, wie die Plastizität von Stromazellen die malignen Eigenschaften von Tumoren regulieren kann.
Um die Einflüsse der Tumormikroumgebung auf einer umfassenden Ebene zu untersuchen, haben wir mit Hilfe der CRISPR/Cas9-Technologie genetische Screens in menschlichen Darmorganoiden durchgeführt. Dies ermöglicht die unvoreingenommene Identifizierung von Tumorsuppressorgenen, die das Wachstum in vitro und nach Xenotransplantation fördern (Michels et al., Cell Stem Cell 2020). In Kombination mit PDOs könnte diese Plattform auch dazu beitragen, individuelle therapeutische Ziele für das kolorektale Karzinom zu entschlüsseln.
Personalisierte Modelle für CRC-Therapie und pharmakogenomisches Screening
PDOs können als präklinisches Modell dienen, um therapeutische Strategien zu identifizieren. In Zusammenarbeit mit Prof. Wels (Georg-Speyer-Haus) haben wir mit chimären Antigenrezeptoren (CAR) modifizierte NK-Zellen verwendet, um die Zytotoxizität gegen Darmkrebszellen zu induzieren. Dazu haben wir enzymatische und Lebendzell-Mikroskopie entwickelt, um die Wirksamkeit der CAR-Zellen zu untersuchen (Schnalzger et al., EMBO Journal 2019).
Als Teilnehmer des EU-Konsortiums „EUbOPEN“ (Enabling and unlocking biology in the OPEN, 2020-2024) haben wir eine PDO-Wirkstoffscreening-Plattform entwickelt. Das EUbOPEN-Konsortium wird von der „Innovative Medicines Initiative“ (IMI2) finanziert und zielt darauf ab, eine frei zugängliche chemogenomische Bibliothek von Wirkstoffen zu erstellen, die humane Genome möglichst umfassend abdeckt. Gemeinsam mit unseren Partnern aus dem akademischen Bereich und der pharmazeutischen Industrie entwickeln wir sog. „Human Tissue Assays“ für CRC. Wir führen pharmakologische Hochdurchsatz-Screens an PDO-Biobanken durch, um Resistenzmechanismen und therapeutische Strategien zu identifizieren.
Das EUbOPEN-Projekt wurde vom „Joint Undertaking Innovative Medicines Initiative 2“ unter der Finanzhilfevereinbarung Nr. 875510 gefördert. Dieses „Joint Undertaking“ wird durch das Forschungs- und Innovationsprogramm Horizont 2020 der Europäischen Union, EFPIA-Unternehmen und assoziierte Partner unterstützt: KTH, OICR, Diamond und McGill. Dieser Bericht gibt die Ansichten der Autoren wieder. Weder die IMI noch die Europäische Union, EFPIA oder ein assoziierter Partner haften für die Verwendung der hierin enthaltenen Informationen.